|
Certains atomes isotopes ont trop de neutrons, ils sont instables, et peuvent
casser. Quand un atome casse, il peut libérer trois choses différentes. Un
atome léger, un électron ou un
positron, ou du rayonnement. Ces atomes qui se
cassent spontanément sont radioactifs. Ce comportement peut être rattaché aux
réactions nucléaires, c'est pour cela que nous le traitons. Mais si nous le
mettons à part, c'est parce que ces désintégrations se font spontanément,
sans intervention extérieure, comme c'est le cas pour la fusion et la fission.
Ces trois émissions différentes ont chacune un nom différent : le
rayonnement alpha, le
rayonnement bêta et le
rayonnement gamma.
 Rayonnement Alpha α
Rayonnement Alpha α
Ce rayonnement est l'émission
d'un atome léger, l'Hélium He. Il a deux protons et deux neutrons. Très
grosses (!), ces particules sont très peu pénétrantes. Il suffit d'une
feuille de papier pour les arrêter. Elles ont une vitesse qui avoisine les
20.000km.s-1 .
 Rayonnement Bêta β
Rayonnement Bêta β
Lorsqu'un atome émet du
rayonnement bêta, il émet un électron ou un positron. Quand un électron est
éjecté, le rayonnement est dit β- (bêta moins), quand c'est
un positron, le rayonnement est dit β+. Beaucoup plus petites,
ces particules sont plus difficiles à arrêter. Une feuille d'aluminium arrive
à les stopper.
 Rayonnement Gamma γ
Rayonnement Gamma γ
Cette fois si, c'est un
rayonnement électromagnétique qui est émis. C'est une onde à très haute
fréquence très destructrice. Pour l'arrêter, du plomb (plusieurs centimètres
d'épaisseur) ou de béton (plusieurs dizaines de centimètres) sont
nécessaires ! Dans les centrales nucléaires, on utilise de l'eau (4 mètres !)
lors du changement de combustible, pour se protéger des radiations. Le
réacteur étant alors à coeur ouvert, ces 4 mètres d'eau évitent que tous
les techniciens soient irradiés.
Cette émission peut être due à ce que l'on peut appeler à
un retour à l'état fondamental, c'est à dire qu'un atome va passer d'un état
excité à un état désexcité. L'atome a un surplus d'énergie, dont il
va se débarrasser pour être stable. Comment se désexcite
un atome ?
Cette émission de rayons gamma accompagne généralement les
rayonnements Alpha et Bêta.
Que font les atomes radioactifs ? Une fois que l'atome
radioactif est cassé
en deux, on a deux atomes. Ils peuvent être stables, ou encore radioactifs.
Dans ce cas, ils se cassent, jusqu'à avoir des atomes stables.
Par exemple, l'Uranium 238. Très radioactif, il va libérer des particules,
et ainsi devenir une autre espèce chimique.. Il va subir
environ 15 transformations avant de former du plomb, qui lui est stable. Mais
cela ne se passe pas en 10 minutes, des milliards d'années sont en effet
nécessaires.
La radioactivité de l'Uranium :
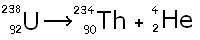
L'Uranium 238 a 92 protons. En émettant une particule alpha,
c'est à dire un atome d'Hélium (qui a deux protons dans son noyau). Il perd
donc deux protons, et quel est l'atome qui a 90 protons dans son noyau ? Le
Thorium ! Or le Thorium est lui aussi radioactif. Mais lui va émettre une
particule bêta moins (un électron).
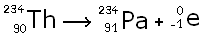
Le e est l'électron éjecté. Le Proctarium (Pa) est
un atome qui a un proton de plus que le Thorium. Mais pourquoi y a t-il autant
de nucléons dans le Thorium que dans le Proctarium ? Et bien dans cette
réaction, un neutron est transformé en un proton, c'est pourquoi le nombre de
masse ne change pas...
Comment vérifier
cette transformation ?
Le temps que met un atome à se désintégrer complètement se mesure. La
période radioactive correspond au temps que met la moitié des atomes d'un
corps à se désintégrer. Prenons l'exemple du Carbone 14. Sa période
radioactive T est égale à 5670ans. Cela veut dire que si un objet est composé
de carbone 14, il perdra la moitié de ses atomes de carbone tous les 5670
ans.
Notons que les êtres vivants absorbent pendant toute leur vie du carbone 14,
mais ils ne les perdent qu'à partir du moment où l'organisme est mort. Ainsi,
en mesurant la quantité d'atome de carbone 14 dans un organisme mort, on peut
arriver à trouver la date approximative de sa mort, en sachant la période
radioactive du carbone 14.
Une petite animation pour illustrer la période
radioactive. Cette barre jaune contient de la matière radioactive, avec
une seconde pour période. Chaque seconde, la moitié de ses atomes se désintègrent
!
Voici la période radioactive
de quelques éléments.
|
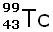 (Technétium)
(Technétium)
|
6 heures
|
|
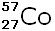 (Cobalt) (Cobalt)
|
270 jours
|
|
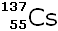 (Césium) (Césium)
|
30 ans
|
|
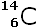 (Carbone) (Carbone)
|
5 670 ans
|
|
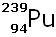 (Plutonium) (Plutonium)
|
24 000 ans
|
|
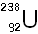 (Uranium) (Uranium)
|
720 000 000 ans
|
Quels sont les effets de ces rayonnements sur l'organisme ?
Pour les particules alpha, elles s'arrêtent en surface de la peau, mais
provoquent des brûlures. Pour les particules bêta, plus petites, elles
s'enfoncent plus profondément dans la peau, de quelques millimètres, mais
elles détruisent toutes les cellules qu'elles rencontrent. Pour le rayonnement gamma,
il traverse tout l'organisme, et détruit toutes les cellules...
Sommes nous radioactifs ?
Oui, mais un tout petit peu ! Cette radioactivité est naturelle. Dans le
sous-sol, on trouve de l'Uranium. Or la salade que nous mangeons, par
exemple, puise ses ressources nutritives dans le sol. Nous voilà alors radioactifs. A cela, on peut
ajouter le rayonnement cosmique, la lumière venant du soleil étant due à des
réactions nucléaires, mais en quantité infime !
Vous savez à présent que la
radioactivité consiste en des désintégrations naturelles des noyaux. Nous
allons à présent regarder les réactions élémentaires des noyaux, les réactions
nucléaires... 
Haut positron* : Le positron est, d'après la théorie vérifiée de
l'anti-matière, l'anti-particule de l'électron. Le positron a donc une
charge électrique positive, et son spin (son sens de rotation) est inversé à
celui de l'électron, mais tout cela est une autre histoire... retour |