|
Dans la partie précédente, nous avons parlé de l'atome. Nous savons
maintenant qu'il y a autant de protons que d'électrons dans l'atome (sauf pour
un ion). Mais pour les neutrons, il n'y a pas de règle précise.
Prenons l'exemple du Carbone 12 qui est dans la classification périodique.
Il y a donc 6 protons, et 6 neutrons (12-6=6). Mais certains atomes de
Carbone ont plus de neutrons. Vous connaissez peut être le
Carbone 14, qui sert
à la datation ? Et bien cet atome de
Carbone 14 a 14 nucléons. C'est-à-dire
qu'il y a 14 particules dans le noyau. Comme c'est un atome de
Carbone, il a
toujours 6 protons. C'est donc qu'il a 2 neutrons dans son noyau en plus du
Carbone 12, ce qui lui fait au total 14-6=8neutrons.
Ces atomes qui ont un nombre de neutrons différent, mais qui ont les mêmes
propriétés chimiques que l'élément de la classification, sont dits isotopes.
Petit test, à présent. Voici l'atome d'hydrogène. Il n'a qu'un proton dans
son noyau.
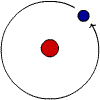
Parmi ces atomes, lequel n'est pas un atome isotope de l'hydrogène ?
Cliquez sur l'image pour avoir la
réponse.
Pourquoi parler des isotopes ? Et bien certains isotopes sont stables. Ils
ont plus de neutrons, mais ils ne cassent pas sous leur propre masse. Par
contre, d'autres sont susceptibles de "casser" à tout moment, ils sont radioactifs.
Pour savoir ce qu'est la radioactivité, venez
!

Haut
|